№20 - Відділ радіаційної біофізики
Завідувач відділу к.ф.-м.н. С.М. Данильченко +3 (0542) 33-30-89, danil@ipflab.sumy.ua
Нова назва відділу із 2012 р. Стара назва: "Відділ мас-спектрометрiї та бiофiзики".

Співробітники відділу: Станіславов А.С., Гусак Е.В., Ільяшенко В.Ю., Яновская А.А., Павленко П.А., Суходуб Л.Ф., Данильченко С.Н., Ковальчук В., Москаленко В.Б.
Напрямки досліджень
Радіаційна біофізика
- участь у розробці та апробації експериментальної бази для досліджень фізичних основ радіаційної терапії: каналів (а) “квазімонохроматичного рентгенівського випромінювання” і (б) “одночастинкового режиму взаємодії”;
- розробка та розвинення методів кількісного визначення ефектів впливу іонізуючого випромінювання на біологічні об’єкти для задач виявлення і оцінки ступені радіаційних ушкоджень (гель-електрофорез/«комет-аналіз», хемілюмінесценція, гістохімічні методи);
- розробка методик дозуючого опромінення як окремих клітин, так і суб-клітинних структур та вивчення ефектів впливу; обробка та інтерпретація експериментальних результатів математичними та комп’ютерними засобами.
Ізотопний аналіз - прискорювальна мас-спектрометрія
- створення, апробація та оптимізація комплексної автоматизованої системи аналітичного спалювання і графітизації вуглець-вмісних зразків для прискорювальної мас-спектрометрії з кількісним визначенням ізотопу 14C;
- розробка методик підготовки газофазних та твердофазних зразків для ізотопного аналізу вуглецю методом ПМС з матеріалів біологічних тканин, клітинних угрупувань та біологічних рідин (наприклад, для вивчення реакції 14N+n→14C+p у живих біологічних системах при нейтронному опроміненні);
- розробка на базі прискорювальої мас-спектрометрії аналітичних методик детектування аддуктів ДНК, інших продуктів розпаду пухлин, протипухлинних лікарських препаратів (включаючи нанокомпозитні матеріали) з використанням ізотопу 14C, що має визначатись на рівні нано- і пікограм в нативному стані.
Біомінералогія та біоматеріали
- отримання стабільних в часі та в умовах дії радіаційного опромінення нанокомпозитних матриць (скаффолдів) для іммобілізації досліджуваних клітин і створення модельних клітинних угруповань (зокрема таких, що моделюють онкологічні пухлини) для дослідження комплексного впливу іонізуючого випромінювання;
- дослідження кристало-хімічних характеристик кальцій-фосфатних патологічних утворень біологічних тканин (онкологічні та серцево-судинні кальцифікати). Визначення особливостей карбонатних заміщень у структурі позаскелетних апатитів людини. Вивчення мікро-морфологічних та концентраційних відмінностей патологічних кальцифікатів різного походження. Створення атласу/каталогу патологічних кальцифікатів людини за даними мікроскопії, мікроаналізу, структурних та спектральних методів. Модельні дослідження динаміки утворення мінерало-протеїновіх комплексів та переродження їх у біополімер-апатитні нанокомпозитні частинки в пересичених кальцієм і фосфором біологічних рідинах та їх штучних аналогах. Визначення переліку речовин і препаратів-інгібіторів патологічної кальцифікації та механізмів їх дії у модельних системах.
Основні досягнення
2022
В рамках виконання міжнародної європейської інноваційної науково-технічної програми "EUREKA" спільно з європейськими партнерами досліджено серію сорбуючих матеріалів на основі хітину та хітозану, отриманого з оболонок личинок Hermetia illucens. Матеріали були додатково магнітномодифіковані для забезпечення можливості селективної магнітної сепарації з розчинів і суспензій, що особливо важливо в промислових біотехнологічних процесах і при обробці різноманітних промислових стічних вод. Оцінено сорбційну здатність цих матеріалів. Матеріали докладно охарактеризовано методами скануючої електронної мікроскопії, рентгенівської дифракції, температурно-програмованої десорбційної мас-спектрометрії, атомно-абсорбційної спектроскопії та елементного аналізу.
(Калінкевич О.B., А Калінкевич О.М., Чіванов В.Д.)
2021
Оцінка співвідношення концентрацій вільних (неапатитних) та структурно зв’язаних мікроелементів кісткової тканини
Автори: Данильченко С.М., Рогульський Ю.В., Калінкевич О.М., Кулик О.М.
Запропоновано та експериментально протестовано метод хімічного розділення апатитної і неапатитної складових кісткової тканини, що базується на їх селективній розчинності з подальшим визначенням мікроелементів, що належать до різних фракцій, методом атомно-абсорбційної спектрометрії. У роботі визначено загальні (інтегральні) концентрації Mg, Zn, Fe, Sr, Cu, Mn, Al, Pb у кістковій тканині кількох різних зразків та концентрації цих мікроелементів у розчинах (вода, NaОН та NH4ОН) з рядом значень pH (6,5; 10 і 12) після активованої ультазвуком взаємодії цих розчинів з дрібнодисперсними порошками висушених зразків. Виміряні таким чином концентрації «лабільних» фракцій мікроелементів критично проаналізовано з урахуванням можливих реакцій утворення і осадження нових нерозчинних фаз. Виходячи з отриманих даних, здатність мікроелементів мати рухомі («лабільні») фракції у складі кісткової тканини можна представити наступним рядом: Mg ≥ Zn > Al > Fe > Mn > Cu > Sr. Застосований у роботі підхід суттєво доповнює аналітичні можливості інших методів, що базуються на рентгенівській абсорбційній спектроскопії (XAS), а саме аналізі біляпорогової структури спектрів поглинання (XANES) і протяжної тонкої структури спектрів поглинання (EXAFS), які застосовуються для отримання інформації про локальну координацію або хімічний статус біологічно значимих іонів фізіологічних та патологічних біомінералів. Такі дослідження спрямовані на уточнення моделі біологічних мінералів (рис. 1) різного походження та відкривають перспективи вивчення залежності переважної локалізації мікроелементів від віку, патології та умов утворення біомінералу.
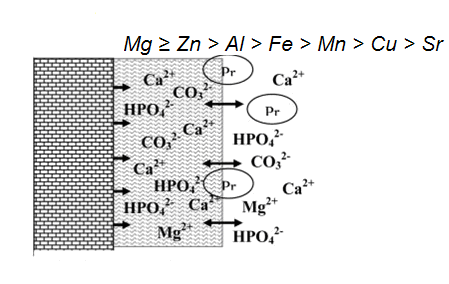
Рис. 1. Структуроване гідратне оточення кристалів біологічного апатиту та обмінні процеси між кристалічним ядром (зліва), неапатитним оточенням (посередині) та зовнішнім середовищем (органічним матриксом, справа); Pr – протеїни
Результати опубліковано у статті:
Danilchenko S. et al. A simple method to determine the fractions of labile and mineral-bound microelements in bone tissue by atomic absorption spectrometry // Biological Trace Element Research (Springer) – 2020. – С. 1-9. https://doi.org/10.1007/s12011-020-02234-4
2019
Експериментально досліджено кінетику видалення водню з електролітично насичених зразків металів, у тому числі двох різних класів сталі (феритної і аустенітной). Температурні залежності виділення водню були отримані за допомогою установки вакуумної температурної екстракції з мас-спектрометричною реєстрацією утворених летючих компонент. Для обох марок сталі процес виділення водню можна представити таким, що складається з двох стадій, які накладаються одна на одну з різним ступенем розділення (рис.). Припускаючи, що кожна стадія відповідає певній формі присутності водню у матеріалі (специфічному місцю локалізації), кінетичні параметри процесу видалення газу оцінювались для обох стадій двох зразків (таблиця). Ідентичність/схожість кінетичних параметрів першої стадії вказує на однакову форму знаходження водню в обох зразках сталі. Вбачається, що це водень поверхневій локалізації. Кінетичні параметри другої («високотемпературної») стадії мають більш відмітну розбіжность, що може свідчити про відмінності у кінетиці температурного видалення водню з приповерхневих шарів α-Fe і γ-Fe. Дані параметри можуть слугувати маркерами локалізації водню у різних сталях та давати можливість порівнювати співвідношення різних форм знаходження водню у них, що надзвичайно важливо для контролю стану реакторних матеріалів.
(Данильченко С.М., Чіванов В.Д., Калінкевич О.М.)
2018
Синтезовано і охарактеризовано серію матеріалів на основі хітозану з інкорпорованими наночастинками металів та окислів металів. Хітозан використовувався у ході отримання наночастинок як реакційний середовище, та як дисперсійне середовище для попередньо утворених наночастинок, а також як субстрат (метали можуть бути включені в поверхню хітозанової плівки). Отримані матеріали мають антимікробну активність, зумовлену наявністю наночастинок.
(О.В. Калінкевич , О.М. Калінкевич)
2016
Оцінено можливість зробити поверхню хітозан-гідроксиапатитних композитних матеріалів зарядженою шляхом обробки коронним розрядом. Досліджено діелектричні та електричні властивості матеріалів методами діелектричної спектроскопії, в тому числі із застосуванням еквівалентних методів і схем комп’ютерного моделювання. Діелектрична спектроскопія показує, що поведінка композитних матеріалів вельми відрізняється від хітозану і гідроксиапатиту поодинці. Отримані значення діелектричних проникливостей викликають значний інтерес в прогнозі поведінки матеріалів в електростимуляції після імплантації. Значення діелектричної проникливості, які спостерігаються при фізіологічній температурі (в діапазонах частот, що застосовувалися) аналогічні значенням для кісткової тканини.
(Калінкевич О.В., Калінкевич О.М., Данильченко С.М.)
2015
Розроблені кровозупинні матеріали на основі хітозану.
(напрям: Розробка нових біологічних матеріалів для військової медицин та медицини надзвичайних ситуацій)
(Калінкевич О.В та Калінкевич О.М. )
2014
Було проведено розробку устаткування для дослідження впливу мікропучків прискорених іонів та рентгенівського випромінювання на біологічні об’єкти, розроблені та випробувані методики аналізу впливу іонізуючого випромінювання на біологічні об’єкти на основі електрофоретичної техніки та люмінесцентного аналізу. Вивчено деякі характеристики модельних біополімерів, чутливі до опромінення прискореними іонами та рентгенівськими фотонами.
Проведена розробка та виготовлення лабораторного устаткування для гель-електрофорезу ДНК, у тому числі «комет-аналізу». Виконані роботи зі створення обладнання для проведення хемолюмінесцентних досліджень з функцією реєстрації власного слабкого світіння об’єктів унаслідок протікання певних хімічних реакцій. Конструкція приладу складається з світлонепроникної камери, де встановлюється досліджуваний зразок у безпосередні близькості від фотокатоду фотоелектронного помножувача ФЕУ-39. Для підбору оптимального режиму роботи ФЕУ напругу можна регулювати в межах 200 - 2000 В. Отриманий сигнал підсилюється попереднім підсилювачем і подається систему виміру швидкості підрахунку імпульсів; тобто проводиться підрахунок кількості імпульсів у заданому проміжку часу. Автоматика формує напругу пропорційну кількості імпульсів (фотонів) котра в свою чергу вимірюється з допомогою 10 бітного АЦП. Після цього мікроконтролер формує пакети даних котрі по шині USB 2.0 передаються до комп'ютера і оброблюються спеціальним програмним забезпеченням.
Спільно з іншими підрозділами Інституту проведена науково-конструкторська робота по створенню каналу “квазімонохроматичного рентгенівського випромінювання” для дослідження біологічної ефективності рентгенівських пучків. Виготовлено основні елементи іонопроводу та несучі конструкції для його механічної фіксації і юстування (стелажні підставки).
(Жовнер Михайло Олександрович, Калінкевич Олексій Миколайович, Вершинський Сергій Олексійович, Данильченко Сергій Миколайович)
2013
З метою дослідження ефектів впливу іонізуючого випромінювання на біологічні об’єкти, продовжено розробку методик комплексної оцінки інтегрального стану клітини, підданої дії рентгенівського випромінення, на основі методу хемілюмінесценції у поєднані з гель-електрофорезом фрагментованої ДНК («комет-аналіз»).
Хемілюмінометр з діапазоном вимірювання випромінення межах 200 – 1100 нм з максимумом чутливості в області 400 - 500 нм буде здатний реєструвати світловий потік інтенсівністю 104 - 108 квант/с.
Виготовлено аналогово-цифрове обладнання для обчислювального та вимірювального блоків хемілюминометра. Продовжуються роботи зі створення високовольтного блоку живлення та підсилювача фотоэлектронного примножувача.
Спільно з іншими підрозділами Інституту ведеться пошукова та науко- во-конструкторська робота по створенню каналу “квазімоно- хроматичного рентгенівського випромінювання” для дослідження біологічної ефективності рентгенівських пучків. Розроблено відповідне технічне завдання та ескізний проект каналу.
Продовжено роботи по налагодженню та випробуванню устаткування підготовки зразків для досліджень методом прискорювальної мас-спектрометрії (установка спалювання зразків і термоаналізу, установка прямого вводу газової проби (СО2) до джерела ПМС, комплексна лабораторна установка спалювання і графітизації вуглецево-вмісних зразків).
Продовжено розробки і дослідження біоматеріалів та покриттів медичного призначення, зокрема проведені дослідження ефектів впливу постійного магнітного поля (0,3 Т) на формування кристалів кальцій-фосфатів.
(В.Д. Чіванов, О.М. Калінкевич, С.В. Новіков, М.О. Жовнер, В.М. Ковальчук)
2012
Отримані і детально вивчені нові композитні матриці (скаффолди) для іммобілізації досліджуваних клітин та створення модельних клітинних угруповань з метою дослідження комплексного впливу іонізуючого випромінювання. Апробовано лабораторні технології отримання скаффолдів у різних формах: хітозанова губка, хітозанове „намисто”, хітозан армований нанокристалічним апатитом, мультимембранний гідрогель. Біосумісність скаффолдів доведено in vivo тестами з вживленням під шкіру, які показали, що через один тиждень пори імплантату (хітозан в композиті з апатитом) заповнюються живими клітинами.
Калінкевич О.В., Калінкевич О.М.
Мультимембранний гідрогель та мікроструктура поверхні хітозанового „намиста”.
.gif)
Пори імплантату (хітозан в композиті з апатитом) заповнені живими клітинами.





.gif)